



Reaksi Asam Basa
Perhatikan video di atas!
-
Zat apa saja yang dimasukkan ke dalam percobaan gunung meletus?
-
Apa sifat dari zat yang dimasukkan dari percobaan gunung meletus?
-
Kenapa hasil dari reaksi bisa muncrat keluar?
-
Apakah reaksi menimbulkan tekanan tinggi ataukah ada zat lain yang dapat mendorong keluar?
-
Apasaja hasil dari reaksi tersebut?
-
Bagaimana persamaan reaksi yang terjadi?
-
Bagaimana sifat dari hasil reaksi tersebut?
Diskusikanlah bersama dengan kelompokmu!
1. Reaksi Penetralan
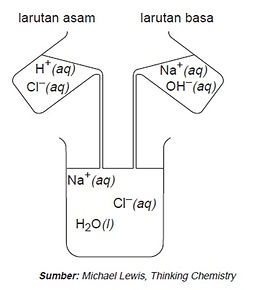
Reaksi asam dengan basa menghasilkan garam dan air. Reaksi ini disebut reaksi penetralan atau reaksi penggaraman.
Asam + Basa -> Garam + Air
Garam adalah senyawa ion yang terbentuk dari ion positif basa dengan ion negatif sisa asam.
Contoh pada reaksi antara larutan asam klorida dengan natrium hidroksida :
HCl (aq) + NaOH (aq) -> NaCl (aq) + H2O (l)
Pada reaksi antara HCl dengan NaOH, ion hidrogen (H+) dan ion hidroksida (OH-) bergabung membentuk molekul air yang bersifat netral.
H+ (aq) + OH- (aq) -> H2O (l)
Ion Na+ dan ion Cl- tetap di dalam larutan NaCl. Jika diuapkan akan dihasilkan NaCl padat atau garam dapur.

2. Reaksi Oksida Basa dengan Asam
Oksida basa adalah oksida logam yang dengan air membentuk basa dan dengan asam membentuk garam dan air. Oksida logam yang larut dalam air membentuk basa hanya oksida dari logam golongan alkali dan alkali tanah (kecuali oksida dari berilium tidak larut dalam air).
Oksida Basa + Asam -> Garam + Air

3. Reaksi Oksida Asam dengan Basa
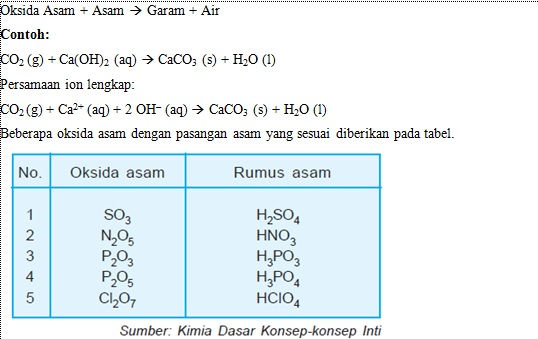
Oksida asam adalah oksida unsur nonlogam yang dengan air membentuk asam dan dengan basa membentuk garam dan air.
Oksida Asam + Asam à Garam + Air
4. Reaksi Logam dengan Asam
Hampir semua logam larut dalam asam kuat (HCI atau H2SO4) membentuk garam dan gas hidrogen. Logam yang tidak larut dalam asam kuat encer yaitu Cu, Hg, Ag, Pt, dan Au. Reaksi logam dengan asam merupakan reaksi redoks. Pada reaksi ini logam teroksidasi membentuk ion logam dengan tingkat oksidasi terendah, sedangkan ion H+ mengalami reduksi membentuk gas hidrogen.
Logam yang lebih reaktif dapat mendesak logam yang kurang reaktif dari larutannya. Urutan kereaktifan dari beberapa logam adalah sebagai berikut:
Li-K-Ba-Ca-Na-Mg-Al-Zn-Cr-Fe-Ni-Sn-Pb-(H)-Cu-Hg-Ag-Pt-Au
Contoh:
Reaksi logam seng dengan larutan tembaga (II) sulfat. Zn akan teroksidasi menjadi Zn2+ yang selanjutnya bergabung dengan ion 2 SO4 membentuk larutan ZnSO4, sedangkan ion Cu2+ tereduksi menjadi logam Cu.

5. Reaksi antara Dua Jenis Garam
Garam 1 + Garam 2 -> Garam 3 + Garam 4
Garam 3 dan (atau) garam 4 sukar larut dalam air.

6. Reaksi Suatu Larutan Garam dengan Suatu Larutan Basa
Garam 1 + Basa 1 -> Garam 2 + Basa 2
Garam 2 dan (atau) basa 2 sukar larut daIam air
Contoh:
Reaksi larutan tembaga(II)sulfat dengan larutan kalsium hidroksida membentuk endapan tembaga(II)hidroksida dan larutan kalsium sulfat (jika konsentrasi larutan yang direaksikan cukup pekat, maka kalsium sulfat yang terbentuk akan mengendap).
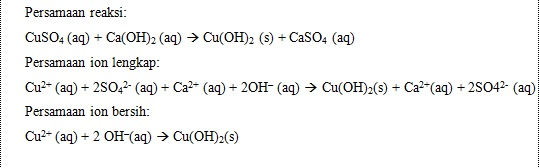
7. Reaksi Suatu Larutan Garam dengan Suatu Larutan Asam
Garam 1 + Asam 1 -> Garam 2 + Asam 2
Garam 2 sukar larut dalam air.
